Beregn tilvæksten i Gibbs-energi ved 25°C
Du kan bruge denne metode, hvis du kender de molare standard Gibbs-energier for de forbindelser, som indgår i reaktionen, og du skal beregne ∆Gθ eller afgøre, om reaktionen forløber spontant ved 298 K (25°C).
I eksamensopgaven omhandlende Gibbs-energi, vil din opgave oftest være at beregne tilvæksten i Gibbs-energi ved standardbetingelselser. Opgavebeskrivelsen kan spørge direkte til størrelsen af gibbs-energitilvæksten eller spørge til, om en bestemt reaktion forløber spontant, som i det gennemgået eksempel længere nede på siden. I begge tilfælde skal du altså beregne gibbs-energitilvæksten ved standardbetingelser og analysere resultatet.
Denne fremgangsmåde kan dog kun benyttes, når temperaturen er 25°C. Hvis temperaturen ikke er givet, skal man bare gå ud fra, at den er 25°C. Hvis temperaturen ikke er 25°C, skal du benytte fremgangsmåden i guiden: Beregn ∆Gθ ud fra ∆Hθ og ∆Sθ.
En eksamensopgave omhandlende entropi kunne lyde således:
Nitrogenoxid og carbonmonooxid er begge giftige gasser, som dannes under forbrændingen i bilmotorer. For at undgå luftforurening sidder der i mange biler en katalysator, som fjerner disse giftige gasser. Reaktionen i katalysatoren ser således ud:
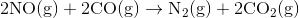
Vis, at reaktionen kan forløbe spontant ved 25°C.
Opgaven består af to dele, henholdsvis en beregningsdel og en forklaringsdel, som vil blive gennemgået i de to nedenstående sektioner.
Beregn ∆Gθ for reaktionen
Når du får givet en eksamensopgave, skal du starte med at læse opgavetek...

