Opløselighedsproduktet
I dette kapitel lærer du om det såkaldte opløselighedsprodukt, som er det samme som ligevægtskonstanten for en ligevægt mellem en ionforbindelse på fast form og i vandig opløsning. Du lærer også om begreber som mættet, umættet og overmættet opløsning.
Intro
Ionforbindelser består af positive og negative ioner. Når en ionforbindelse går i opløsning i vand, går iongitteret i stykker, og de positive ioner bliver i vandet adskilt fra de negative ioner. Vi ser her et eksempel med ionforbindelsen AgCl (sølvchlorid):
AgCl(s) → Ag+(aq) + Cl-(aq)
Den modsatte reaktion kan også ske, så ionerne kan gå sammen igen og gendanne iongitteret:
Ag+(aq) + Cl-(aq) → AgCl(s)
Da reaktionen altså er reversibel, kan vi opskrive den med dobbeltpile:
AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
Reaktionsbrøken for denne reversible reaktion ser således ud:
Vi bemærker, at sølvchlorid på fast form, AgCl(s), helt er udeladt fra reaktionsbrøken, fordi faste stoffer ikke skrives med i reaktionsbrøken. Reaktionsbrøken for denne type reaktioner kaldes også for ionproduktet. Det skyldes, at for denne type reaktioner, vil reaktionsbrøken altid være et produkt af nogle ioners aktuelle koncentrationer.
Opløselighedsproduktet
Nogle ionforbindelser er letopløselige, mens andre er tungtopløselige. AgCl (sølvchlorid) er et eksempel på en tungtopløselig ionforbindelse. Du kan ikke opløse ret meget af denne ionforbindelse i vand, og derfor vil en del AgCl normalt forblive på fast form, selvom det kommer i kontakt med vand. I denne situation vil der opstå en ligevægt mellem det faste sølvchlorid, og de ioner, der er blevet opløst i vandet.
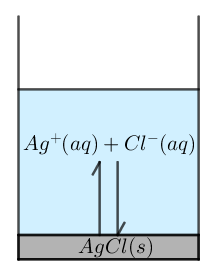
Når der har indstillet sig en ligevægt, vil ionproduktet være lig med ligevægtskonstanten, Ko:
Vi bemærker, at der er skrevet et lille 'o' ved ligevægtskonstanten, Ko. Det er fordi, ligevægtskonstanten for denne type ligevægt også kaldes for opløselighedsproduktet. Grunden til dette navn er, at opløselighedsproduktet er et produkt af nogle ioners aktuelle koncentrationer, som beskriver, hvor meget der kan opløses af den pågældende ionforbindelse i vand.
Eksempler på opløselighedsprodukter
Opløselighedsproduktet varierer alt efter, hvilken ionforbindelse, vi har med at gøre. Vi ser her en tabel med opløselighedsprodukter:
| Ionforbindelse | Ko |
| AgCl | 1,78·10-10 M2 |
| AgI | 8,52·10-17 M2 |
| Mg(OH)2 | 5,61·10-12 M3 |
Hvis opløselighedsproduktet er et meget lille tal, kan der kun opløses meget lid...

![[Ag^{+}]\cdot [Cl^{-}]](/media/webbooks/preview/1622/17943/images/equations/vrvbxb0zbtudg65jzvbzya==.svg)
![K_o=[Ag^{+}]\cdot [Cl^{-}]](/media/webbooks/preview/1622/17943/images/equations/l7krqofrkplxu9g3je1b7a==.svg)
